Entalpi Pembentukan. Entalpi pembentukan adalah perubahan entalpi dalam pembentukan satu mol senyawa atau zat dalam kondisi standar. Ada beberapa jenis perubahan entalpi standar, yaitu: Entalpi jenis ini dilengkapi dengan huruf f, yang dibentuk. Jadi agar dapat menemukan entalpi pembentukan 1 mol koefisien seluruh reaksi bisa di bagi 2.
 Education Entalpi Pembentukan From nharandha.blogspot.com
Education Entalpi Pembentukan From nharandha.blogspot.com
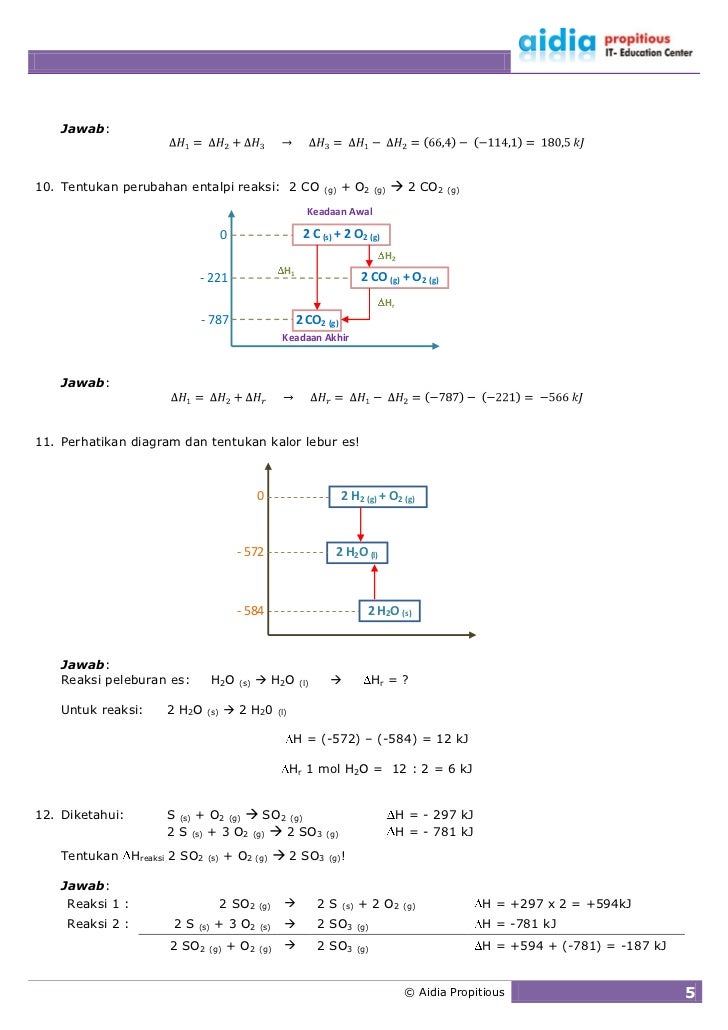
Jadi agar dapat menemukan entalpi pembentukan 1 mol koefisien seluruh reaksi bisa di bagi 2. Entalpi pembentukan standar ($\delta h_{f}^{\circ}$) perubahan entalpi standar pada pembentukan 1 mol zat langsung dari unsur unsurnya pada keadaan standar (298 k, 1 atm). Entalpi reaksi juga bergantung pada wujud zat yang dinyatakan dengan membutuhkan indeks (s) untuk zat padat, (l) untuk zat cair dan (g) untuk zat gas. Jika tidak diukur pada keadaan standar maka perubahan entalpi pembentukan dinotasikan ∆h ⊖ f. H 2, n 2, o 2, f 2, cl 2, br 2, dan i 2. Hitunglah harga x pada diagram siklus tersebut!
Sejauh ini telah dipelajari bahwa dapat ditentukan perubahan entalpi yang menyertai reaksi dengan mengukur kalor yang diserap atau dilepaskan (pada tekanan tetap).
Perubahan entalpi penetralannetralan [[ ∆h∆hnetnet]] • adalah jumlah panas yang dilepas ketika 1 mol air terbentuk akibat reaksi netralisasi asam oleh basa atau sebaliknya. Jika tidak diukur pada keadaan standar maka perubahan entalpi pembentukan dinotasikan ∆h ⊖ f. Ada beberapa jenis perubahan entalpi standar berdasarkan jenis reaksi kimia yang terjadi pada wujud zat. Perubahan entalpi standar (∆ho) untuk berbagai reaksi. Pembentukan 117 g garam dapaur (nacl) membebaskan kalor sebanyak 822 kj b. Entalpi pembentukan standar ($\delta h_{f}^{\circ}$) perubahan entalpi standar pada pembentukan 1 mol zat langsung dari unsur unsurnya pada keadaan standar (298 k, 1 atm).
 Source: masdayat.net
Source: masdayat.net
Entalpi pembentukan standar diberi simbol (δh f), simbol f berasal dari kata formation yang berarti pembentukan. Entalpi pembentukan (hf) pembentukan entalpi adalah panas dalam pembentukan molekul tertentu dari reaktan. Entalpi pembentukan dilambangankan dengan hf. Perubahan entalpi pembentukan dinyatakan dengan lambang ∆h f o atau dinotasikan cukup dengan ∆h f. Simbol untuk entalpi pembentukan pada kondisi standar adalah ??h?_f^o.

Secara umum, reaksi kimia mengarah pada pembentukan produk senyawa baru, yang mengarah pada pe rubahan unit pendidikan. 6.6 entalpi reaksi dan entalpi pembentukan standar. Jadi agar dapat menemukan entalpi pembentukan 1 mol koefisien seluruh reaksi bisa di bagi 2. Simbol theta superskrip pada simbol di atas mengindikasikan bahwa babak ini hanya berlangsung hanya pada kondisi standar saja. Entalpi jenis ini dilengkapi dengan huruf f, yang dibentuk.
 Source: brainly.co.id
Source: brainly.co.id
Secara umum, reaksi kimia mengarah pada pembentukan produk senyawa baru, yang mengarah pada pe rubahan unit pendidikan. Perhatikan siklus hess berikut!berdasar siklus hess di atas, besarnya perubahan entalpi pembentukan standar atau delta hf so3 (g) adalah. Perubahan entalpi penetralannetralan [[ ∆h∆hnetnet]] • adalah jumlah panas yang dilepas ketika 1 mol air terbentuk akibat reaksi netralisasi asam oleh basa atau sebaliknya. Sejauh ini telah dipelajari bahwa dapat ditentukan perubahan entalpi yang menyertai reaksi dengan mengukur kalor yang diserap atau dilepaskan (pada tekanan tetap). Perubahan entalpi pembentukan standar (∆h f) adalah perubahan entalpi setiap mol senyawa yang terbentuk dalam suatu reaksi kimia pada kondisi standar.perhatikan contoh soal entalpi pembentukan standar dan pembasannya berikut ini untuk lebih memahami entalpi pembentukan standar.
 Source: fiskadiana.blogspot.co.id
Source: fiskadiana.blogspot.co.id
Perubahan entalpi pembentukan dinyatakan dengan lambang ∆h f o atau dinotasikan cukup dengan ∆h f. Entalpi pembentukan dilambangankan dengan hf. Dengan persamaan reaksi sebagai berikut. Perubahan entalpi pembentukan standar (∆h f) adalah perubahan entalpi setiap mol senyawa yang terbentuk dalam suatu reaksi kimia pada kondisi standar.perhatikan contoh soal entalpi pembentukan standar dan pembasannya berikut ini untuk lebih memahami entalpi pembentukan standar. Perhatikan diagram siklus reaksi termokimia berikut!

Ada beberapa jenis perubahan entalpi standar, yaitu: Entalpi pembentukan merupakan panas yang terlibat dalam pembentukan satu mol senyawa tertentu dari reaktan. Entalpi pembentukan dilambangankan dengan hf. Entalpi pembentukan standar mempunyai simbol ∆h f o.superskrip nol pada fungsi termodinamik mengindikasikan adanya proses yang berlangsung pada keadaan standar. 6.6 entalpi reaksi dan entalpi pembentukan standar.
 Source: slideshare.net
Source: slideshare.net
Dari persamaan (6.9) diketahui bahwa δh juga dapat dihitung jika diketahui entalpi yang sebenarnya untuk semua reaktan dan produk. Ada beberapa jenis perubahan entalpi standar, yaitu: Merupakan perubahan entalpi jika 1 mol suatu zat terbakar sempurna pada kondisi standar. Entalpi pembentukan standar diberi simbol (δh f), simbol f berasal dari kata formation yang berarti pembentukan. Perubahan entalpi pembentukan standar, ∆h f o.
 Source: brainly.co.id
Source: brainly.co.id
Gas pada keadaan standar yang bentuknya molekul diatomik : Sejauh ini telah dipelajari bahwa dapat ditentukan perubahan entalpi yang menyertai reaksi dengan mengukur kalor yang diserap atau dilepaskan (pada tekanan tetap). Jadi agar dapat menemukan entalpi pembentukan 1 mol koefisien seluruh reaksi bisa di bagi 2. Jika tidak diukur pada keadaan standar maka perubahan entalpi pembentukan dinotasikan ∆h ⊖ f. Simbolnya adalah δhfθ atau δfhθ.
 Source: seputarbentuk.blogspot.com
Source: seputarbentuk.blogspot.com
Entalpi reaksi juga bergantung pada wujud zat yang dinyatakan dengan membutuhkan indeks (s) untuk zat padat, (l) untuk zat cair dan (g) untuk zat gas. Pada pembentukan satu melahir dari gas hidrogen dengan gas oksigen dibebaskan 286 kj kata “dibebaskan” menyatakan bahwa reaksi tergolong eksoterm. Perubahan entalpi pembentukan standar, ∆h f o. Entalpi pembentukan standar benzena adalah 49,04 kj/mol. H 2, n 2, o 2, f 2, cl 2, br 2, dan i 2.
 Source: brainly.co.id
Source: brainly.co.id
Entalpi pembentukan adalah perubahan entalpi dalam pembentukan satu mol senyawa atau zat dalam kondisi standar. Dari persamaan (6.9) diketahui bahwa δh juga dapat dihitung jika diketahui entalpi yang sebenarnya untuk semua reaktan dan produk. Apabila materi ini berguna, bagikan ke teman atau rekan kamu supaya mereka juga mendapatkan manfaatnya. Entalpi pembentukan (hf) pembentukan entalpi adalah panas dalam pembentukan molekul tertentu dari reaktan. Berdasarkan definisi, entalpi pembentukan standar untuk unsur bebas adalah nol.
 Source: studentsasia.blogspot.com
Source: studentsasia.blogspot.com
Entalpi pembentukan standar ($\delta h_{f}^{\circ}$) perubahan entalpi standar pada pembentukan 1 mol zat langsung dari unsur unsurnya pada keadaan standar (298 k, 1 atm). Perubahan entalpi pembentukan dinyatakan dengan lambang ∆h f o atau dinotasikan cukup dengan ∆h f. Dengan kondisi tekanan standar dipahami ketika reaksi pembentukan dilakukan pada tekanan atmosfer satu atmosfer dan pada suhu kamar 25 derajat celcius atau 298,15 kelvin. Pembentukan 117 g garam dapaur (nacl) membebaskan kalor sebanyak 822 kj b. • persamaan reaksinya asam + basa garam + h2o • untuk netralisasi asam kuat.
 Source: seputarbentuk.blogspot.com
Source: seputarbentuk.blogspot.com
Simbol theta superskrip pada simbol di atas mengindikasikan bahwa babak ini hanya berlangsung hanya pada kondisi standar saja. Entalpi pembentukan adalah sekumpulan nilai ∆h yang melambangkan perubahan entalpi dari reaksi untuk menghasilkan zat kimia. Di sini, kamu akan belajar tentang entalpi pembentukan standar melalui latihan soal interaktif dalam 3 tingkat kesulitan (mudah, sedang, sukar). H 2, n 2, o 2, f 2, cl 2, br 2, dan i 2. Jika kamu mengetahui entalpi pembentukan yang.
 Source: nharandha.blogspot.com
Source: nharandha.blogspot.com
6.6 entalpi reaksi dan entalpi pembentukan standar. Sejauh ini telah dipelajari bahwa dapat ditentukan perubahan entalpi yang menyertai reaksi dengan mengukur kalor yang diserap atau dilepaskan (pada tekanan tetap). Entalpi pembentukan merupakan panas yang terlibat dalam pembentukan satu mol senyawa tertentu dari reaktan. Entalpi jenis ini dilengkapi dengan huruf f, yang dibentuk. Entalpi pembentukan standar benzena adalah 49,04 kj/mol.
 Source: djokosri.blogspot.com
Source: djokosri.blogspot.com
Perubahan entalpi pembentukan standar (∆h f) adalah perubahan entalpi setiap mol senyawa yang terbentuk dalam suatu reaksi kimia pada kondisi standar.perhatikan contoh soal entalpi pembentukan standar dan pembasannya berikut ini untuk lebih memahami entalpi pembentukan standar. Apabila materi ini berguna, bagikan ke teman atau rekan kamu supaya mereka juga mendapatkan manfaatnya. Perubahan entalpi pembentukan standar, ∆h f o. Perubahan entalpi (δh 0) dipengaruhi suhu dan tekanan yang diukur pada kondisi standar.kondisi standar yaitu pada tekanan 1 atm dan suhu 25 0 c atau 298 k dengan satuan kj, sedangkan satuan δh molar reaksi adalah kj/mol. Entalpi pembentukan dilambangankan dengan hf.
 Source: learnataubelajar.blogspot.com
Source: learnataubelajar.blogspot.com
• persamaan reaksinya asam + basa garam + h2o • untuk netralisasi asam kuat. Ada beberapa jenis perubahan entalpi standar, yaitu: Berdasarkan diagram tersebut, perubahan entalpi pembentukan 47,8 g pbo2 (ar pb = 207gmol−1 dan o = 16 gmol−1) yaitu. Simbolnya adalah δhfθ atau δfhθ. Entalpi pembentukan (hf) pembentukan entalpi adalah panas dalam pembentukan molekul tertentu dari reaktan.
 Source: brainly.co.id
Source: brainly.co.id
Entalpi pembentukan dilambangankan dengan hf. Simbol untuk entalpi pembentukan pada kondisi standar adalah ??h?f^o. Entalpi pembentukan merupakan panas yang terlibat dalam pembentukan satu mol senyawa tertentu dari reaktan. Entalpi pembentukan standar ($\delta h{f}^{\circ}$) perubahan entalpi standar pada pembentukan 1 mol zat langsung dari unsur unsurnya pada keadaan standar (298 k, 1 atm). Pembentukan 5,6 l gas co2 (stp) membebaskan kalor sebanyak 98,5 kj (diket:
 Source: chem.co.id
Source: chem.co.id
Entalpi pembentukan standar mempunyai simbol ∆h f o.superskrip nol pada fungsi termodinamik mengindikasikan adanya proses yang berlangsung pada keadaan standar. Berdasarkan definisi, entalpi pembentukan standar untuk unsur bebas adalah nol. Maka akan diketahui pada pembentukan 2 mol c3h8 yang melepaskan kalor sebesar 225 kj. Entalpi pembentukan dilambangankan dengan hf. Dengan persamaan reaksi sebagai berikut.
 Source: learnataubelajar.blogspot.com
Source: learnataubelajar.blogspot.com
Simbol theta superskrip pada simbol di atas mengindikasikan bahwa babak ini hanya berlangsung hanya pada kondisi standar saja. Dari persamaan (6.9) diketahui bahwa δh juga dapat dihitung jika diketahui entalpi yang sebenarnya untuk semua reaktan dan produk. Entalpi pembentukan standar diberi simbol (δh f), simbol f berasal dari kata formation yang berarti pembentukan. Simbolnya adalah δhfθ atau δfhθ. Sebagai contoh untuk mengetahui entalpi pembentukan nacl maka kita harus menuliskan reaksinya dari unsur natrium dan gas klorin.
 Source: brainly.co.id
Source: brainly.co.id
Pada pembentukan satu melahir dari gas hidrogen dengan gas oksigen dibebaskan 286 kj kata “dibebaskan” menyatakan bahwa reaksi tergolong eksoterm. Entalpi pembentukan adalah sekumpulan nilai ∆h yang melambangkan perubahan entalpi dari reaksi untuk menghasilkan zat kimia. Entalpi pembentukan standar benzena adalah 49,04 kj/mol. Dengan persamaan reaksi sebagai berikut. Pembentukan 13 g gas (c2h2) memerlukan kalor sebanyak 113 kj c.
This site is an open community for users to submit their favorite wallpapers on the internet, all images or pictures in this website are for personal wallpaper use only, it is stricly prohibited to use this wallpaper for commercial purposes, if you are the author and find this image is shared without your permission, please kindly raise a DMCA report to Us.
If you find this site value, please support us by sharing this posts to your own social media accounts like Facebook, Instagram and so on or you can also bookmark this blog page with the title entalpi pembentukan by using Ctrl + D for devices a laptop with a Windows operating system or Command + D for laptops with an Apple operating system. If you use a smartphone, you can also use the drawer menu of the browser you are using. Whether it’s a Windows, Mac, iOS or Android operating system, you will still be able to bookmark this website.