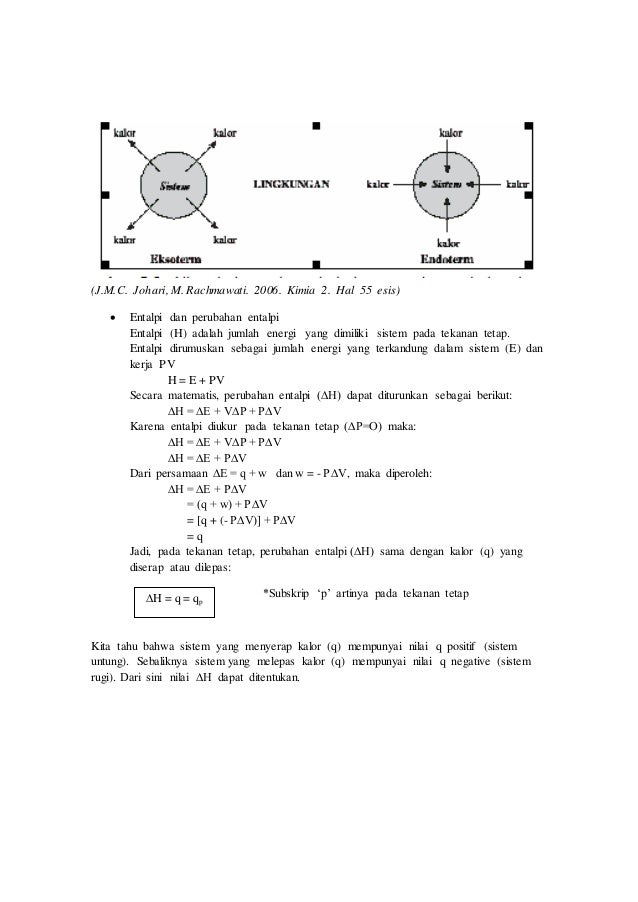
Penentuan Perubahan Entalpi. Reaksi yang terjadi ketika berlangsungnya penyerapan panas atau kalor, maka perubahan entalpi reaksi bernilai positif. Besarnya perubahan entalpi (δh) sama dengan besarnya panas reaksi, tapi dengan tanda berlawanan. Q = (m x c x δt) + (c x δt) keterangan : Kalorimetri adalah pengukuran secara kuantitatif terhadap panas yang masuk selama proses kimia.
 PENENTUAN PERUBAHAN ENTALPI BERDASARKAN DATA ENERGI IKATAN From youtube.com
PENENTUAN PERUBAHAN ENTALPI BERDASARKAN DATA ENERGI IKATAN From youtube.com
Perubahan entalpi pada reaksi ini digambarkan sebagai berikut: Kondisi standar dilakukan pada suhu 25 0 c atau 298 k dan tekanan 1 atm. Reaksi pembakaran karbon tidak mungkin hanya menghasilkan gas co saja tanpa disertai terbentuknya gas co 2. Ma + nb →pc + qd Tahukah kamu bahwa perubahan entalpi dapat kita tentukan melalui percobaan mengukur perubahan kalor selama reaksi berlangsung. Pengukuran perubahan entalpi suatu reaksi kadangkala tidak dapat ditentukan langsung dengan kalorimeter, misalnya penentuan perubahan entalpi pembentukan standar (d h f 0) co.
Pengukuran perubahan entalpi suatu reaksi kadangkala tidak dapat ditentukan langsung dengan kalorimeter, misalnya penentuan perubahan entalpi pembentukan standar (dhf o )co.
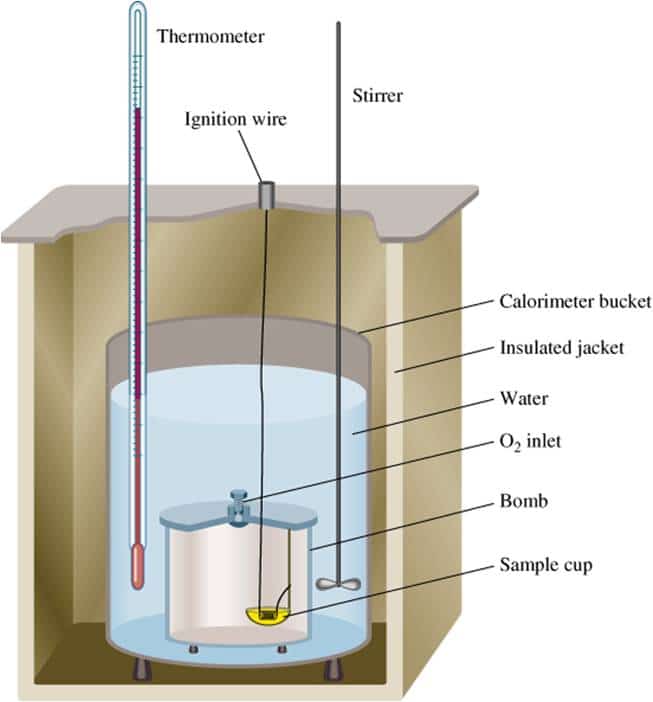
Hukum hess adalah hukum yang digunakan untuk menentukan besarnya perubahan entalpi suatu reaksi. Persamaan 1 dibalik karena kita menginginkan ch 4 di sebelah kiri. 1 dalam suatu eksperimen, didapati 50 Lkpd perubahan entalpi reaksi lembar kerja peserta didik id: Q = kalor reaksi (j) m = massa zat( g) c = kalor jenis zat (j/g oc atau j/gk) δt = perubahan suhu ( oc atau k) c = kapasitas kalor zat (j/ oc atau j/k) Penentuan perubahan entalpi melalui percobaan kalorimetri.
 Source: slideshare.net
Source: slideshare.net
Harga perubahan entalpi (∆h) suatu reaksi dapat ditentukan dengan berbagai cara, antara lain ialah dengan cara kalorimetri, hukum hess, dan dengan menggunakan perubahan entalpi pembentukan. Hukum hess adalah hukum yang menyatakan bahwa perubahan entalpi suatu reaksi akan sama walaupun reaksi tersebut terdiri dari satu langkah atau banyak langkah. Penentuan perubahan entalpi suatu reaksi dapat dilakukan secara empirik maupun secara semiempirik. Kalor suatu reaksi dapat juga ditentukan dari data entalpi pembentukan z bereaksi dan produknya. Khusus untuk soal tertentu seperti reaksi dalam larutan dan reaksi tanpa perubahan koefisien, besarnya perubahan entalpi dapat dihitung berdasar hasil ukur kalorimeter.
 Source: academia.edu
Source: academia.edu
Q = (m x c x δt) + (c x δt) keterangan : A short summary of this paper. Aggar lebih jelas perhatikan contoh soal menentukan perhitungan entalpi dengan kalorimeter berikut ini. 28 full pdfs related to this paper. Supaya entalpi dapat dihitung, maka pengukurannya harus dilakukan pada suhu serta tekanan tertentu.

Kalor suatu reaksi dapat juga ditentukan dari data entalpi pembentukan z bereaksi dan produknya. Perubahan entalpi pada reaksi endoterm dirumuskan sebagai berikut: Penentuan perubahan entalpi suatu reaksi dapat dilakukan secara empirik maupun secara semiempirik. Perubahan entalpi tidak dipengaruhi oleh jalannya reaksi, melainkan hanya tergantung pada keadaan awal dan akhir, ∆ h 1 = ∆h 2 + ∆h 3. Selain menggunakan kalorimeter dan hukum hess kita juga dapat menentukan nilai perubahan entalpi (∆h) reaksi menggunakan energi ikatan.
 Source: youtube.com
Source: youtube.com
Penentuan perubahan entalpi dengan kalorimeter merupakan cara sederhana untuk menentukan perubahan entalpi dengan menggunakan satuan kalori. Hukum hess adalah hukum yang menyatakan bahwa perubahan entalpi suatu reaksi akan sama walaupun reaksi tersebut terdiri dari satu langkah atau banyak langkah. Pengukuran pada kondisi standar dinotasikan dengan ∆ho atau ∆h 298, sedang di luar kondisi standar dinyatakan dengan ∆h saja. Tentukan perubahan entalpi reaksi ch 4 (g) + 2o 2 (g) → co 2 (g) + 2h 2 o(g). Menurut hukum kekekalan energi :
 Source: slideshare.net
Source: slideshare.net
Dapat menentukan perubahan entalpi suatu zat bila diketahui massa,kapasitas kalor,dan perubahan suhu zat tsb berarti kita memakai rumus dengan kalorimeter : Q = kalor reaksi (j) m = massa zat( g) c = kalor jenis zat (j/g oc atau j/gk) δt = perubahan suhu ( oc atau k) c = kapasitas kalor zat (j/ oc atau j/k) Penentuan entalpi δh reaksi secara empirik secara empirik , artinya melakukan pengukuran secara langsung di laboratorium berdasarkan perubahan suhu reaksi karena suhu merupakan ukuran panas (kalor). Penentuan perubahan entalpi dengan kalorimeter merupakan cara sederhana untuk menentukan perubahan entalpi dengan menggunakan satuan kalori. Menurut para kimiawan, suhu 25°c dan tekanan 1 atm adalah ukuran yang tepat untuk menilai entalpi.
 Source: youtube.com
Source: youtube.com
Reaksi yang ditanya memiliki peraksi ch 4 (g) + 2o 2 (g) dan hasil co 2 (g) + 2h 2 o(g). Full pdf package download full pdf package. Secara umum untuk reaksi : Penentuan perubahan entalpi melalui percobaan kalorimetri. 2nh3 n2 (g) + 3h2 (g) + 26,78 kkal.
 Source: youtube.com
Source: youtube.com
Sehingga secara umum penentuan entalpi reaksi melalui energi ikat adalah: Kalorimetri kalor yang dilepaskan oleh sistem akan diserap oleh air / larutan dan kalorimetri, jadi dalam percobaan kalorimetri ada 3 jenis kalor yaitu : Reaksi yang terjadi ketika berlangsungnya penyerapan panas atau kalor, maka perubahan entalpi reaksi bernilai positif. Tahukah kamu bahwa perubahan entalpi dapat kita tentukan melalui percobaan mengukur perubahan kalor selama reaksi berlangsung. Tentukan perubahan entalpi reaksi ch 4 (g) + 2o 2 (g) → co 2 (g) + 2h 2 o(g).
 Source: slideshare.net
Source: slideshare.net
Perubahan entalpi pada reaksi ini digambarkan sebagai berikut: Kalorimetri kalor yang dilepaskan oleh sistem akan diserap oleh air / larutan dan kalorimetri, jadi dalam percobaan kalorimetri ada 3 jenis kalor yaitu : Hukum hess adalah hukum yang menyatakan bahwa perubahan entalpi suatu reaksi akan sama walaupun reaksi tersebut terdiri dari satu langkah atau banyak langkah. Cara menentukan perubahan entalpi (δh) dapat dilakukan dengan percobaan kalorimetri, data entalpi pembentukan (δhºf), data energi ikat dan hukum hess. Penentuan perubahan entalpi dengan kalorimeter merupakan cara sederhana untuk menentukan perubahan entalpi dengan menggunakan satuan kalori.
 Source: youtube.com
Source: youtube.com
Dalam hukum hess, nilai perubahan entalpi dinyatakan sebagai fungsi keadaan ( ∆ h). Reaksi yang ditanya memiliki peraksi ch 4 (g) + 2o 2 (g) dan hasil co 2 (g) + 2h 2 o(g). Sehingga secara umum penentuan entalpi reaksi melalui energi ikat adalah: Secara umum untuk reaksi : Reaksi pembakaran karbon tidak mungkin hanya menghasilkan gas co saja tanpa disertai terbentuknya gas co 2.
 Source: youtube.com
Source: youtube.com
Cara menentukan perubahan entalpi (δh) dapat dilakukan dengan percobaan kalorimetri, data entalpi pembentukan (δhºf), data energi ikat dan hukum hess. Penentuan perubahan entalpi berdasarkan energi ikatan. Sehingga secara umum penentuan entalpi reaksi melalui energi ikat adalah: Pengukuran perubahan entalpi suatu reaksi kadangkala tidak dapat ditentukan langsung dengan kalorimeter, misalnya penentuan perubahan entalpi pembentukan standar (dhf o )co. Penentuan entalpi δh reaksi secara empirik secara empirik , artinya melakukan pengukuran secara langsung di laboratorium berdasarkan perubahan suhu reaksi karena suhu merupakan ukuran panas (kalor).
 Source: slideshare.net
Source: slideshare.net
Reaksi yang terjadi ketika berlangsungnya penyerapan panas atau kalor, maka perubahan entalpi reaksi bernilai positif. Menurut para kimiawan, suhu 25°c dan tekanan 1 atm adalah ukuran yang tepat untuk menilai entalpi. Menurut hukum kekekalan energi : Penentuan perubahan entalpi melalui percobaan kalorimetri. Reaksi pembakaran karbon tidak mungkin hanya menghasilkan gas co saja tanpa disertai terbentuknya gas co 2.
 Source: youtube.com
Source: youtube.com
Hukum hess adalah hukum yang digunakan untuk menentukan besarnya perubahan entalpi suatu reaksi. Suatu perubahan entalpi yang diukur dengan ukuran standar akan disebut perubahan entalpi standar. Kalorimetri adalah pengukuran secara kuantitatif terhadap panas yang masuk selama proses kimia. Hukum hess adalah hukum yang menyatakan bahwa perubahan entalpi suatu reaksi akan sama walaupun reaksi tersebut terdiri dari satu langkah atau banyak langkah. Khusus untuk soal tertentu seperti reaksi dalam larutan dan reaksi tanpa perubahan koefisien, besarnya perubahan entalpi dapat dihitung berdasar hasil ukur kalorimeter.
 Source: youtube.com
Source: youtube.com
Penentuan perubahan entalpi berdasarkan energi ikatan. Penentuan perubahan entalpi suatu reaksi dapat dilakukan secara empirik maupun secara semiempirik. Kalor suatu reaksi dapat juga ditentukan dari data entalpi pembentukan z bereaksi dan produknya. Penentuan perubahan entalpi berdasarkan energi ikatan. Khusus untuk soal tertentu seperti reaksi dalam larutan dan reaksi tanpa perubahan koefisien, besarnya perubahan entalpi dapat dihitung berdasar hasil ukur kalorimeter.
 Source: youtube.com
Source: youtube.com
Q = kalor reaksi (j) m = massa zat( g) c = kalor jenis zat (j/g oc atau j/gk) δt = perubahan suhu ( oc atau k) c = kapasitas kalor zat (j/ oc atau j/k) Full pdf package download full pdf package. Perubahan entalpi standar (∆ho) untuk berbagai reaksi. 500 ml = 0,05 l. Hukum hess adalah hukum yang digunakan untuk menentukan besarnya perubahan entalpi suatu reaksi.
 Source: jempolkimia.com
Source: jempolkimia.com
Menurut para kimiawan, suhu 25°c dan tekanan 1 atm adalah ukuran yang tepat untuk menilai entalpi. Hukum hess adalah hukum yang digunakan untuk menentukan besarnya perubahan entalpi suatu reaksi. Menurut hukum kekekalan energi : Sehingga secara umum penentuan entalpi reaksi melalui energi ikat adalah: Menurut para kimiawan, suhu 25°c dan tekanan 1 atm adalah ukuran yang tepat untuk menilai entalpi.
 Source: youtube.com
Source: youtube.com
Selain menggunakan kalorimeter dan hukum hess kita juga dapat menentukan nilai perubahan entalpi (∆h) reaksi menggunakan energi ikatan. Q = (m x c x δt) + (c x δt) keterangan : Susun sedemikian rupa tiga persamaan yang lain agar dihasilkan persamaan reaksi yang ditanya. Kondisi standar dilakukan pada suhu 25 0 c atau 298 k dan tekanan 1 atm. Perubahan entalpi pada reaksi ini digambarkan sebagai berikut:
 Source: pelajaran.co.id
Source: pelajaran.co.id
500 ml = 0,05 l. Q = (m x c x δt) + (c x δt) keterangan : Selain menggunakan kalorimeter dan hukum hess kita juga dapat menentukan nilai perubahan entalpi (∆h) reaksi menggunakan energi ikatan. Penentuan perubahan entalpi melalui percobaan kalorimetri. Full pdf package download full pdf package.
 Source: youtube.com
Source: youtube.com
Pengukuran pada kondisi standar dinotasikan dengan ∆ho atau ∆h 298, sedang di luar kondisi standar dinyatakan dengan ∆h saja. Pengukuran perubahan entalpi suatu reaksi kadangkala tidak dapat ditentukan langsung dengan kalorimeter, misalnya penentuan perubahan entalpi pembentukan standar (dhf o )co. Kalorimetri kalor yang dilepaskan oleh sistem akan diserap oleh air / larutan dan kalorimetri, jadi dalam percobaan kalorimetri ada 3 jenis kalor yaitu : Penentuan perubahan entalpi berdasarkan hukum hess. Secara umum, nilai perubahan perubahan entalpi bergantung pada jenis reaksinya, yaitu perubahan entalpi positif (endoterm) serta negatif (eksoterm).
This site is an open community for users to do submittion their favorite wallpapers on the internet, all images or pictures in this website are for personal wallpaper use only, it is stricly prohibited to use this wallpaper for commercial purposes, if you are the author and find this image is shared without your permission, please kindly raise a DMCA report to Us.
If you find this site good, please support us by sharing this posts to your favorite social media accounts like Facebook, Instagram and so on or you can also save this blog page with the title penentuan perubahan entalpi by using Ctrl + D for devices a laptop with a Windows operating system or Command + D for laptops with an Apple operating system. If you use a smartphone, you can also use the drawer menu of the browser you are using. Whether it’s a Windows, Mac, iOS or Android operating system, you will still be able to bookmark this website.





